『日経研月報』特集より
シリーズ「AI×○○」第2回
医療におけるAI応用の現状と将来
2025年12-2026年1月号
1. 要 約
人工知能の技術は、1970年代からMedical Expert Systemとして研究レベルでの臨床応用がアメリカを中心に進み、AI in Medicineという研究領域が確立した。当時は、電子カルテのプラットフォーム上での診断支援のためのプログラムが目標であった。エキスパートシステムの問題を解決するため、定性推論、時間推論を適用したIntelligent Monitoringをはじめとして、さまざまな方法が提案されたが、AIの冬の時代が訪れて、研究も下火となった。AIの流れが大きく変わったのは、2000年代後半に登場したデータマイニング、機械学習、知識工学の最終形態と考えるIBMのWatsonであるが、その傾向をさらに跳躍させたのは、深層学習による画像診断の飛躍的向上である。2015年以降、放射線画像の診断ツールをはじめとし、アメリカを中心にさまざまなシステムが開発されたが、2017年FDAがこのような診断システムを医療機器プログラム(Software as Medical Device:SaMD(以下、SaMD))として認定する基準が定められ、それ以降、SaMDが次々と承認されるようになった。この基準の特徴は、いままでの医療機器の基準は厳格な計測精度であったが、FDAは「機械学習を実装したプログラムが将来的に厳格な計測精度を与えるに至る」という管理プロセスを開発業者が実装し、それにより計測精度が高くなる、という保証のもとの基準である。
現在、SaMDは多く認定され、日本でもPMDAからSaMDの認定基準を定め、日本においてもさまざまな深層学習をはじめとする機械学習の機能を実装したSaMDが認定され始めた。認定当初、SaMDは放射線診断をはじめとした画像診断の機器に補助的に実装されるシステムが認可されることが多かった。2020年代に入って、他の検査機器に機械学習が含まれた検査支援システムが次々と認可されている。
以上のように、現在のAIによる診断支援の多くは、検査機器と結びつく形となっており、電子カルテシステムにより診療録を含めた支援を行うシステムではなかったが、2021年にChatGPTが登場して以降、生成AIを利用した診療録を含めた、テキスト処理の支援という手法が登場してきた。現在、ハルシネーションという大きな問題があり、それを抑制して、SaMD基準を満たすものは登場しておらず、あくまで電子カルテシステム同様、診療補助というフェーズであるが、徐々に医療の現場に導入され始めている。
本稿では、医療の現状、過去のAIの医療応用を概観した後、2020年代以降のAI応用の潮流である、SaMDと生成AIを中心に述べていく。
2. 医療の現状:ここ30年ほどでの変化
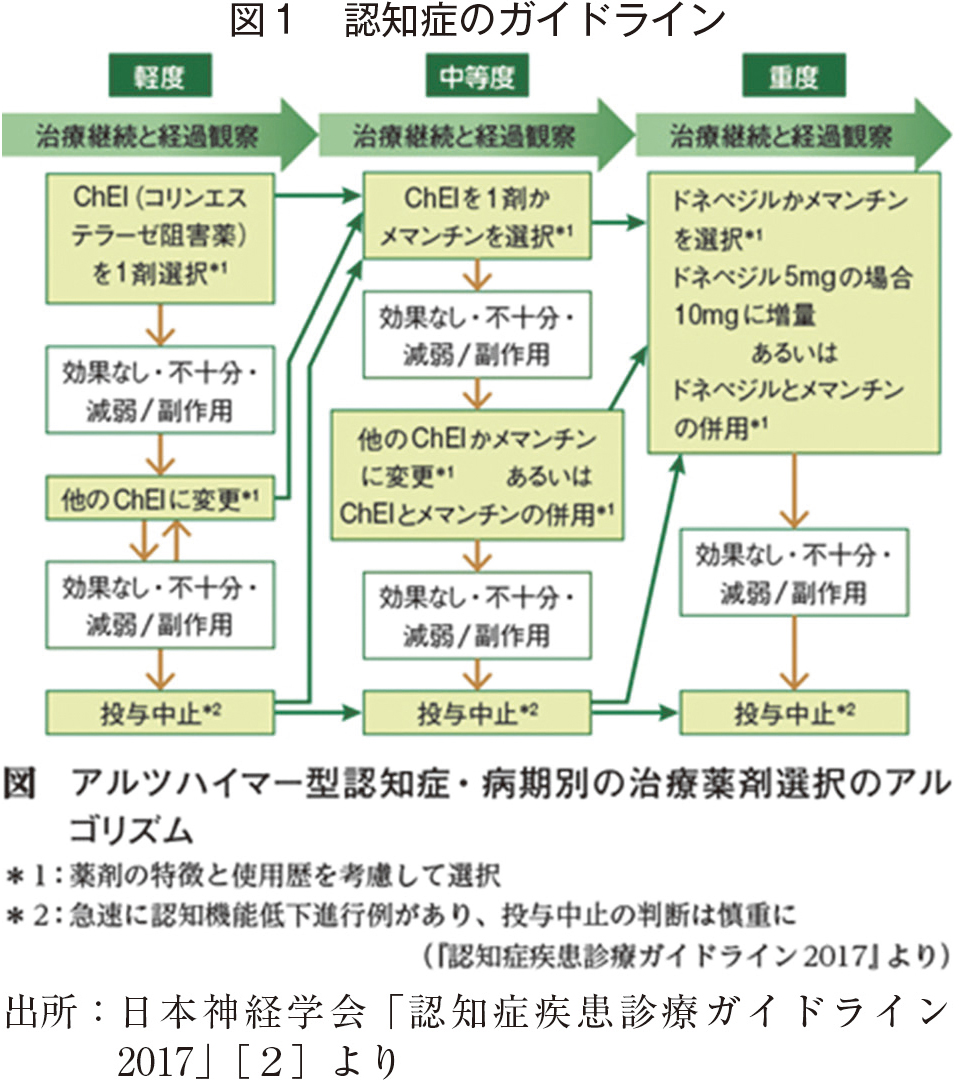
医療は長らく人が人を診断・治療するプロセスによるものであり、検査機器が登場するまでは機械が使用されることはなかった。しかし、心電図、脳波、X線画像等の導入が診断の精度を高めるとともに、治療の評価を可能とし、検査機器なくては専門的な診療は不可能となった。この中で、医師の仕事は、検査機器を駆使して、また医薬品を駆使あるいは手術によって治療するプロセスとして確立されてきたのが、2000年代までの姿であった。しかし、その後、医師の診療のうち、文書作成、治療経過の支援としての電子カルテが登場、検査機器の検査結果が電子カルテ内に提示されるようになり、診療現場は様変わりし始めた。2020年代には、ほとんどの大規模病院では、電子カルテシステムを使い、診療が行われている。一方、2000年代より、専門家の診療をより科学的な根拠に基づき行おうというEvidence-Based Medicine:EBM(以下、EBM)の流れが始まり、20年ほどをかけて、このEBMは診療ガイドライン作成の手順として定着している。現在ポータルサイトMindsには537個掲載されているが、これらは、診療をアルゴリズム的に記述するものであり(例えば図1:認知症疾患診療ガイドライン[2])、計算機上に実装することが容易である。このように、EBMの進展により、診療の過程が標準化され、電子的に提示することでの診療支援の実現が可能になってきている。今後、電子カルテシステムでの診療支援において、以上のようなガイドラインをはじめとしたアルゴリズムの実装という形に生成AIが補助的に使われる可能性がある。
3. AI in Medicine登場当初
3.1 エキスパートシステム
診断支援の基本的な仕組みは、スタンフォード大学のShortliffが1976年に開発して発表した「MYCIN」[3]で基本的な仕組みが考えられていて、現在のAI研究の言葉[4]で言えば、「診断エージェント」と定義できるであろう(図2)。ここで、Perceptsは症状、所見、検査所見であり、Actionsは診断に相当する。
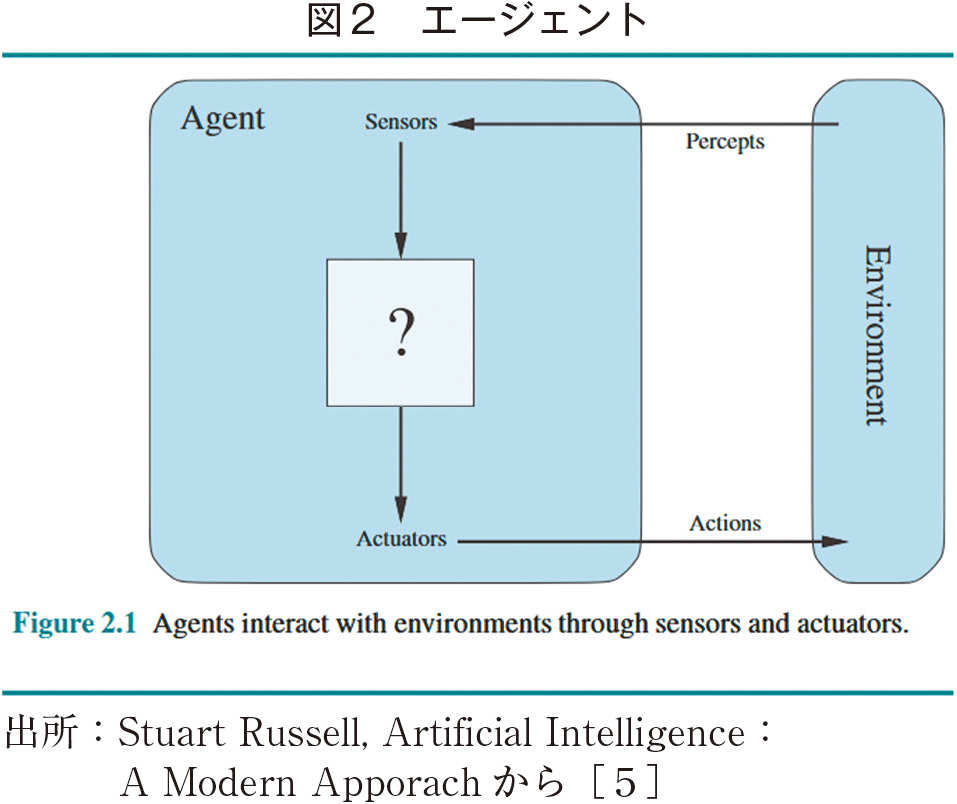
MYCINは細菌感染症診断のシステムであるが、約500のIf-thenルールで構築され、症状、細菌検査の所見を入力することで、細菌感染症の診断を出力する。構築後、実際のスタンフォード大学での症例で評価したところ、65%ほどの正答率であった。実際の専門医の診断精度が80%程度であったことから、この結果は専門医に衝撃を与え、その後さまざまなシステムが開発され、第二次AIブームの一翼を担うに至った。
この場合、図2における「?」がエージェントの推論機構であり、「ルールベース」というルールの集合体といえる。
3.2 エキスパートシステムの限界
さまざまなエキスパートシステムが開発されたが、診断支援のツールとしては次のような理由で広まらなかった。(1)入力に手間がかかる。(2)ルールで判断できる典型的な症例の診療支援しかできない。(3)診断だけで、継続的な支援(診断→治療/経過観察)ができない。(4)機械が間違いを学習しない。
これらは、医療応用に限らず、一般のAI応用における問題であり、これらを解決するために、1990年以降の研究が大きく分けて、以下の3つの方向性で検討されるに至った。(1)エージェント:知能を持ったプログラムに高度な機能を与えることを目標とし、プログラムをエージェントと捉え、ある問題解決に取り組むプログラムとしてのエージェントを研究する領域。ソフトウェアエージェントともよばれるが、多数のプログラムが共同で作業をするマルチエージェントの研究が盛んである。(2)知識表現、オントロジー:If-thenルールは、表層的な専門家の知識を表現するものであるが、この知識表現をより柔軟で、「深い」専門家の知識を表現・実装することで、複雑な症例も診断できるような知識表現を考える領域。現在では、オントロジー、知識グラフというキーワードで研究が進められている。(3)データから知識を学習するプログラムの構築が機械学習として研究され始め、その中で、機械学習の応用スタイルとして、データマイニングという分野が登場した。この3つの流れの中で、機械学習が2010年以降、特に深層学習の登場によって大きな成果を上げ、機械学習の実装による診断精度の向上が、機械学習を実装した医療機器という概念に到達したのが2020年代となる。
4. 深層学習登場以前の診療支援
4.1 IBM Watson
深層学習の放射線画像診断への適用以前には、知識を膨大に蓄積することでの診断支援という試みが続けられており、その成果の1つがIBMのWatsonである。Watsonはクイズ番組で、米国のチャンピオンに勝ったということから注目されたが、医療の領域では当時の東大医科学研究所の宮野氏がゲノム解析の分野でWatsonを利用したシステムを構築し、実際に専門医では診断が困難であった稀少疾患の診断に関する文献を探し出し、この結果から、適切な診断と治療が行われた例が挙げられる[5,6]。
この結果が示すものは、がんゲノム関係の3,000万以上の中から適切な論文を抽出し、診断・治療に結びつけるには、膨大な知識ベースの蓄積とそこからの知識抽出が必要であるということであり、この当時はかなりの労力を用いてチューンアップすることが必要であった。ここで、ChatGPTをはじめとする生成AIの実現が医療においても衝撃を与えているのは、上記のようなWatsonの行った問題解決が、学習を重ねた生成AIによってより容易に実現できるのではないかということである。
4.2 DocsApp(MediBuddy社)[7]
深層学習による放射線画像診断、生成AI登場以前のAI活用のシステムの1つがスマホでのチャットによる診断支援を行う、インドのDocsAppというシステムである。DocsAppでは、患者がチャットによって症状を入力すると、問診のモードに入り、次々の質問がされていく。入力されたチャットは自然言語処理で処理され、キーワードから診断ルールを用いて、その症例がプログラムでの出力のみで問題ないか、より専門的な診断が必要かの判断がされる。このチャットのやりとりは、バックヤードにある医師たちに通知されており、専門的な診療が必要な場合、チャットは医師にバトンタッチされる。
場合によっては、検査がオーダーされ、血液検査などは検査会社が患者宅に向かい、検査を行う。画像検査等必要であれば、その後の紹介等の処置がされるというサービスが行われている。これらのチャットのデータは、症例データベースとして蓄積され、機械学習が適用されることで、診断エンジンが更新される。システムの規模は現在インド全体で活用されており、一日7,000人以上が受診している。背後には、700人以上の医師が参加しており、オンライン診療のプラットフォームとして確立している。インドは、日本のような保険診療制度が完備されていないため、補助的なシステムとして発達してきた。なお、日本では、このようなオンライン診療は許可されていなかったが、コロナによる時期を経て、制限付きではあるが、オンライン診療は認められ始めている。
以上のような手法は、深層学習およびそれによる生成AI登場以前の診療支援の到達点であった。

5. 医療機器プログラム(SaMD)
5.1 米国FDAでの登場
FDAでは、2017年Digital Health Innovation Action Planを掲げ、Software as Medical Device:SaMD(以下、SaMD)という概念を提案、その認証手続きを最終的に2019年に[8]の形でまとめた。ここで重要なのは、Good ML Practiceという考え方(図4)であり、これに基づく医療機器の開発ライフサイクルも掲げている(図5)。
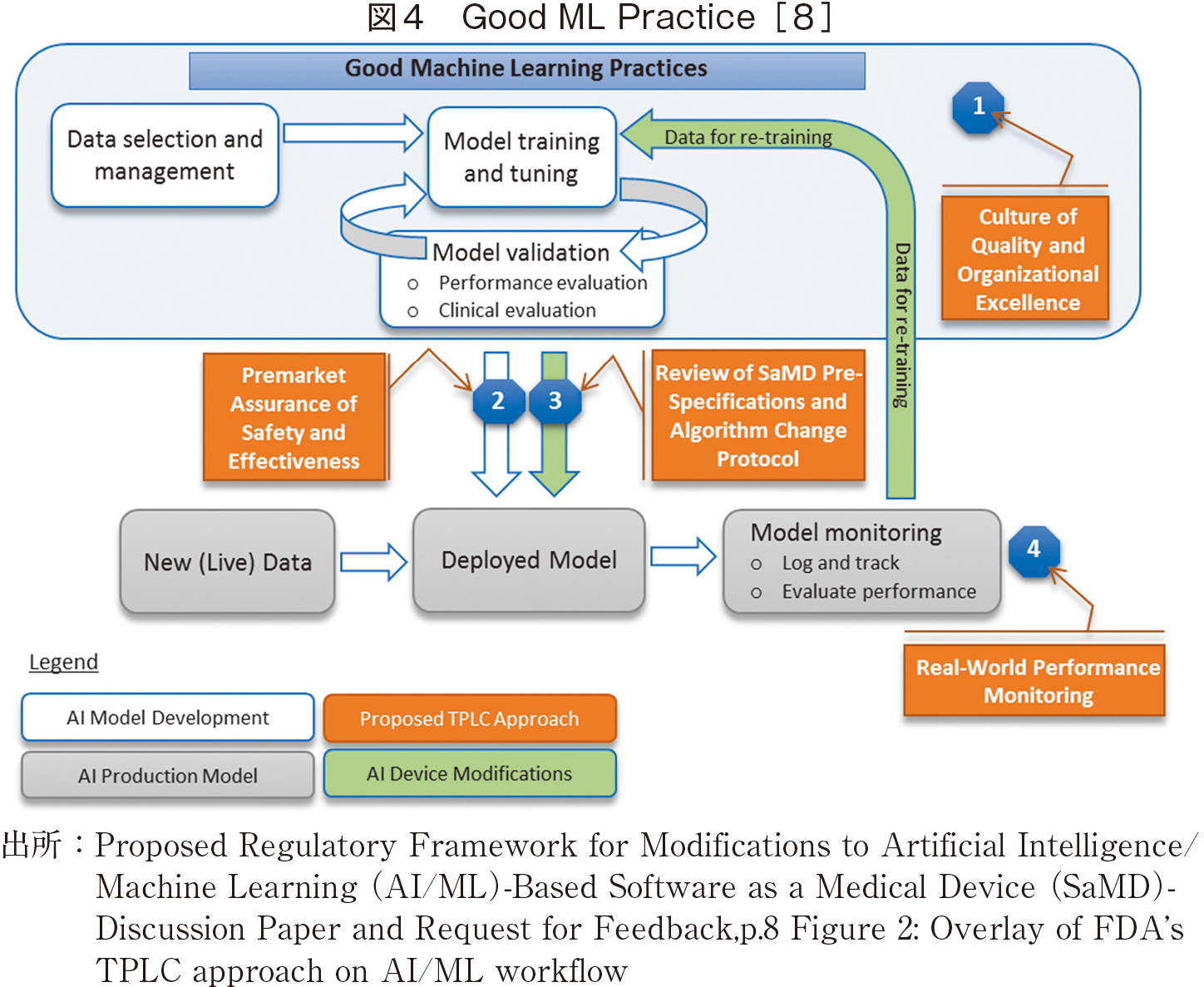
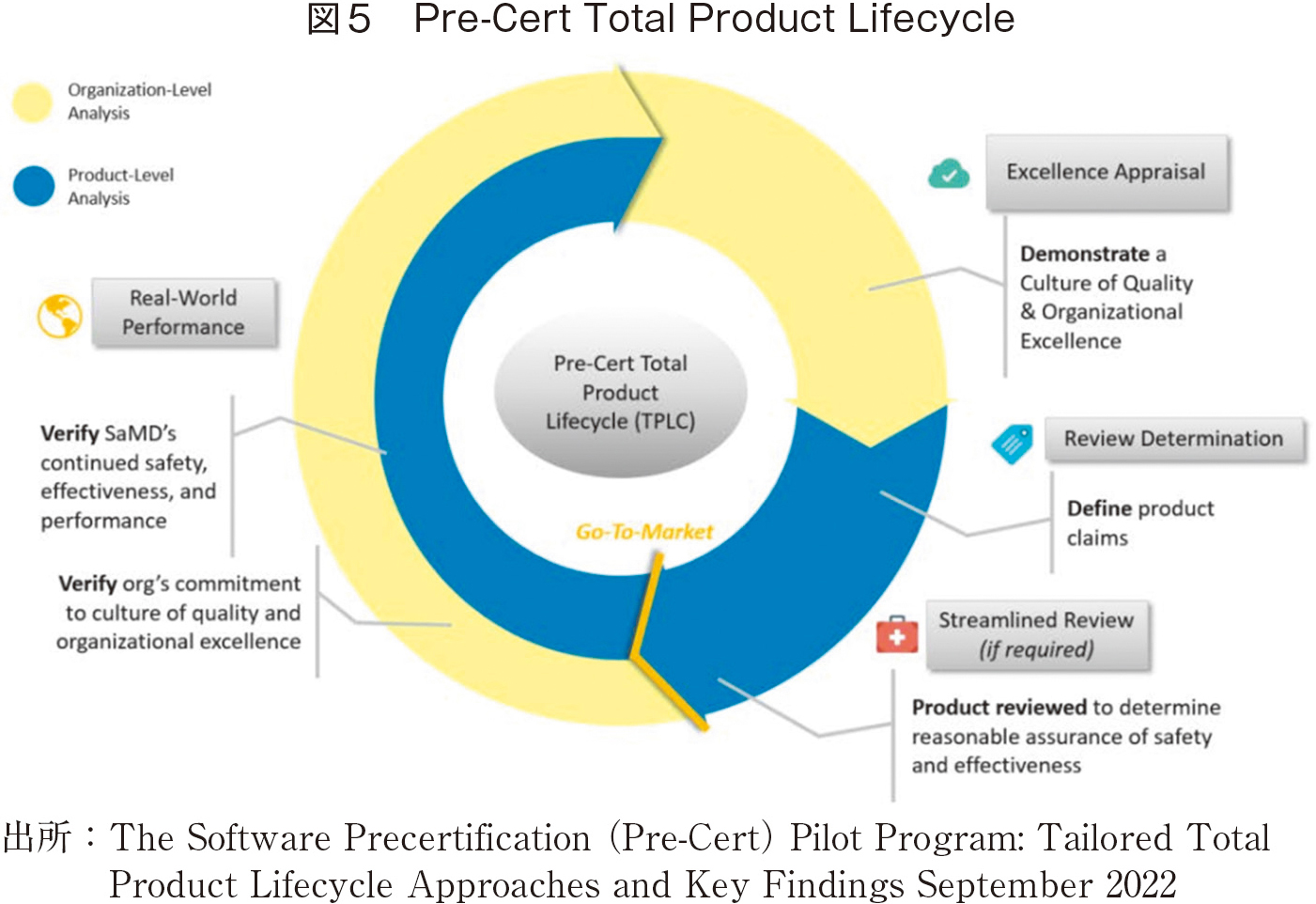
これらの考え方のもと、FDAでは、2017年以降、医療機器プログラムが多数認証されるに至った。現在、FDAはWebサイトで認可されたプログラムの一覧を公開している[10]。2025年11月で膨大な数となっているが、これらのほとんどが放射線画像関係であり、他領域はごく少数であることは注目すべきであろう。
5.2 日本においての経緯
これに遅れて、日本では、医薬品医療機器総合機構(PDMA)が米国のFDAの如く医療機器の認可を行っているが、FDAにより医療機器の認可を受け、2020年代において検討を始めている。
この以前から、さまざまな健康機器等の登場により、医療機器の考え方をより拡張的に捉えなければならない状況が訪れていた。2005年以前では、医療機器として認証される医療機器は、治療に直結し、誤作動が人体へのリスクを高くするものであり、厳格な精度基準を満たすものが認証されてきた。しかし、さまざまな機器が導入されるに至り、2005年の制度改正により、医療機器は以下のクラスに分類、拡張されるに至った。
現在、医療機器は次のように分類されている。
(1)一般医療機器(クラスI):不具合が生じた場合でも、人体へのリスクが極めて低いと考えられるもの。例:体外診断用機器、鋼製小物(メス等)
(2)管理医療機器(クラスII):不具合が生じた場合でも、人体へのリスクが比較的低いと考えられるもの。例;MRI装置、内視鏡、超音波診断装置
(3)高度管理医療機器(クラスIII):不具合が生じた場合、人体へのリスクが比較的高いと考えられるもの。例:透析器、人工関節
(4)高度管理医療機器(クラスIV):患者への侵襲性が高く、不具合が生じた場合、生命の危険に直結する恐れがあるもの。例:ペースメーカー
この中で、プログラムが医療機器として審査・認定されているものは、クラスIIとクラスIIIに相当し、現在、[10]に以下のような審査ポイントが掲げられている。腹膜透析治療計画プログラム、歯科インプラント用治療計画支援プログラム、眼科手術用治療計画プログラム、病変検出用内視鏡画像診断支援プログラム、医用画像の読影支援を目的としたコンピューター診断支援プログラム。
SaMDの種類
SaMDは疾病診断用SaMD、疾病治療用SaMDに大きく分けられ、概念的要求事項は表1のごとく定められている。
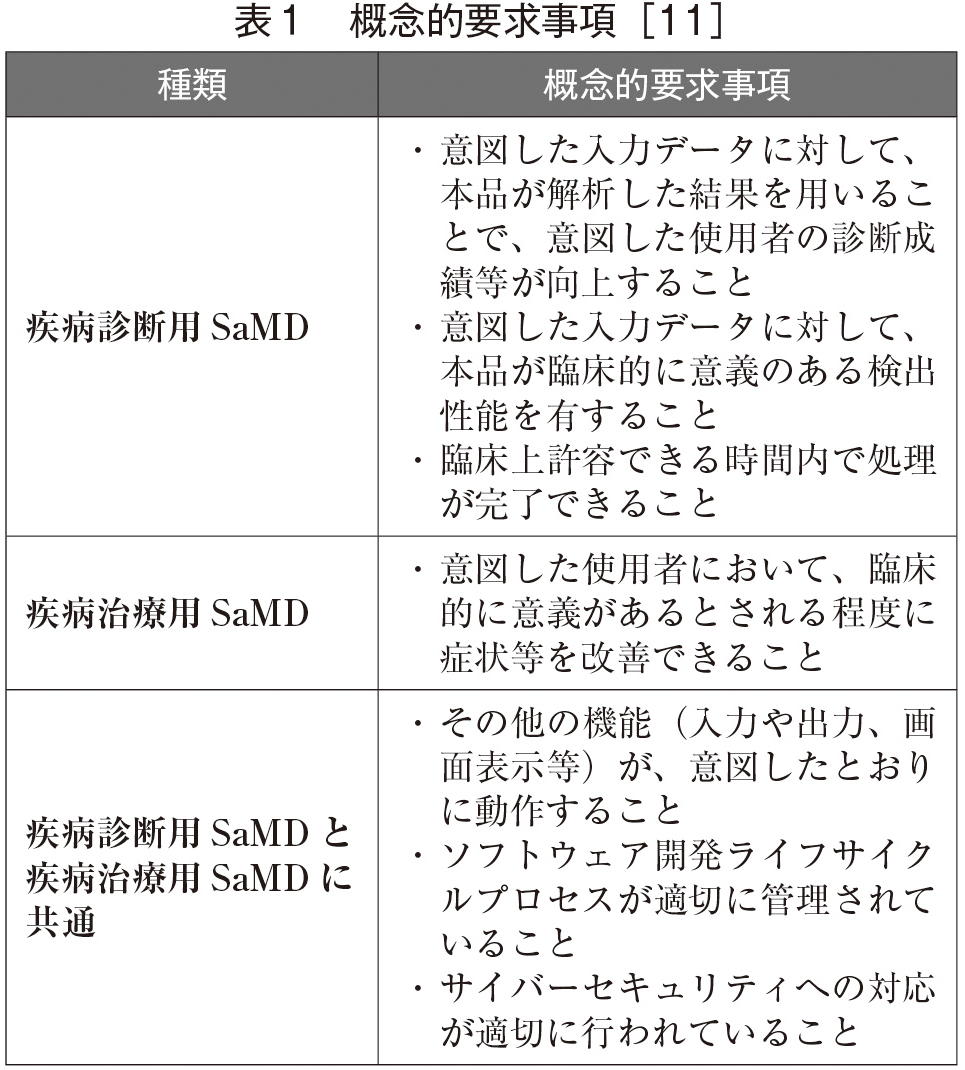
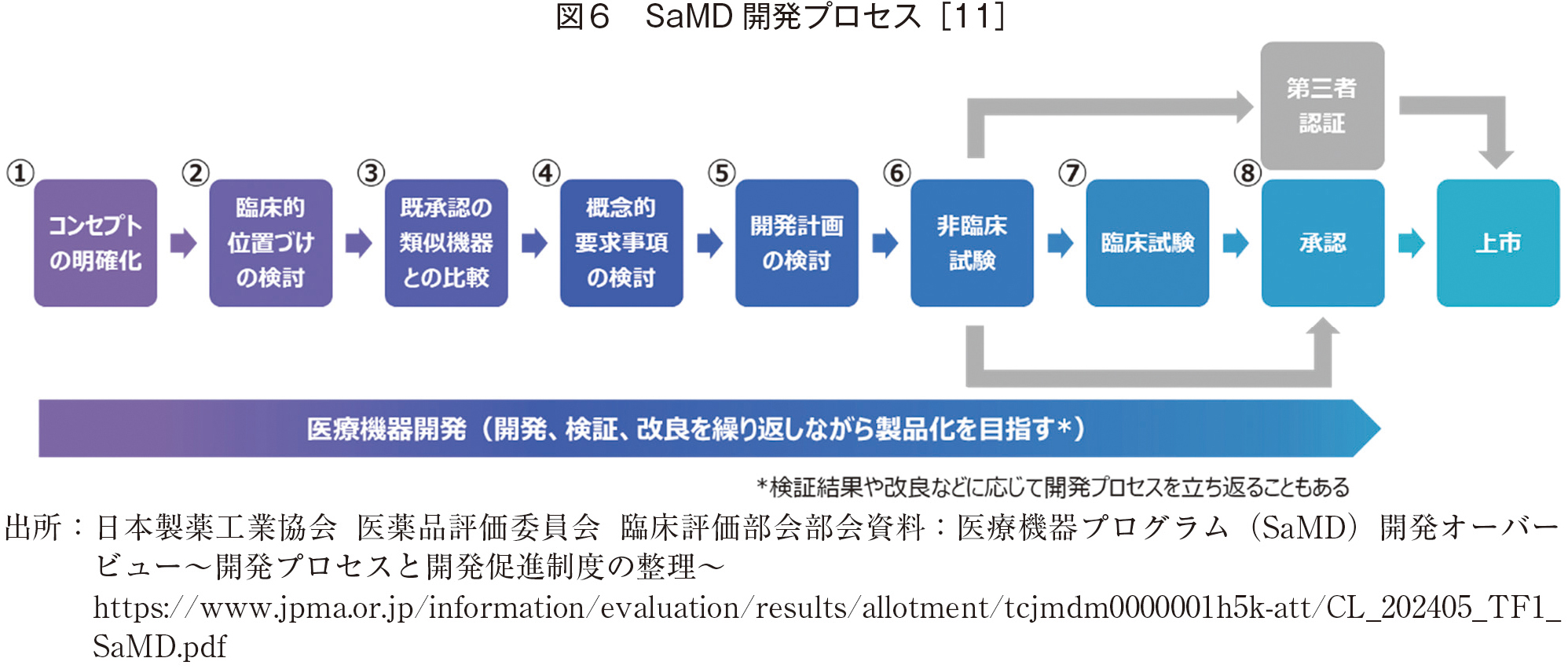
SaMDの開発プロセスについては、[11]に詳しい。
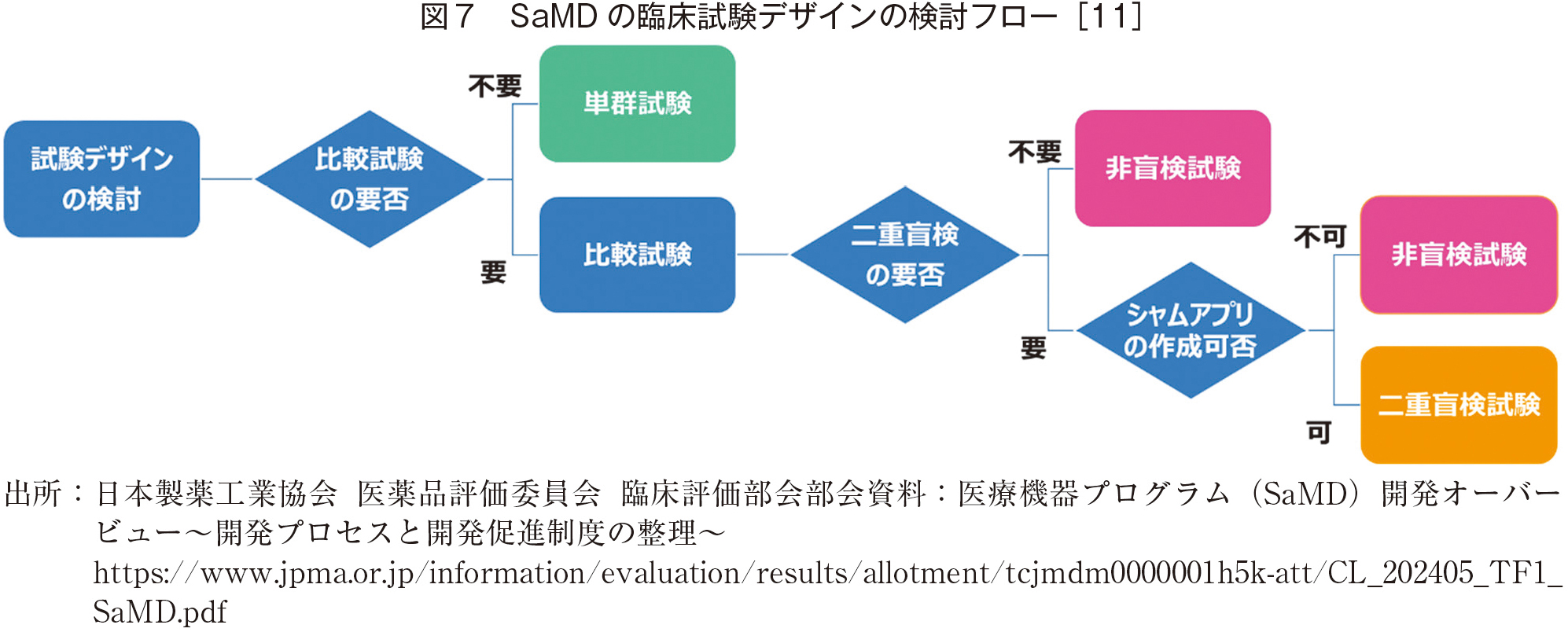
図6にプロセスを概説したが、基本的に通常のシステム開発がベースとなっている。試験の過程において、臨床試験、第三者認証の過程が他システムとは異なる。特に、疾病治療用の場合は、この臨床試験には図2のような適切なプロセスの適用が必要であり、これは、通常の治療薬の認証に基づいている。
https://www.jpma.or.jp/information/evaluation/results/allotment/tcjmdm0000001h5k-att/CL_202405_TF1_SaMD.pdf
https://www.jpma.or.jp/information/evaluation/results/allotment/tcjmdm0000001h5k-att/CL_202405_TF1_SaMD.pdf
5.3 認可されたSaMDの例
PMDAでは、認可された医療機器については、Webページに掲載されている[12]が、数としては、FDAに質も量も劣っている。ここでは、認可されたSaMDのうち、筆者が興味深いと考えたnodocaと内視鏡画像診断支援システム:gastroAI model-Gについて概説する。なお、この2つのシステム開発者が、2025年の人工知能学会全国大会企画セッション「画像診断AIの医療応用の現状と問題点」にて発表した内容を元に以下の項をまとめている。
(1)nodoca[13]
nodocaは、アイリス株式会社の沖山翔氏が開発したインフルエンザ検査機器であり、2022年4月認可後、2022年12月に販売を開始、日本全国で2,000を超える医療機関に導入されている。nodocaは、専用カメラで撮影した咽頭画像と問診情報等をもとに画像診断AIが判定する、患者の痛みが少ないインフルエンザ検査を提供している[4]。
(2)gastroAI model-G[14,15]
AIメディカルサービスの多田智裕氏は内視鏡画像診断支援システムの開発を開始し、2023年12月に認可を受け、その後、バージョンアップ版を提供している。内視鏡画像診断システムの実用化についての現状を紹介した。同システム開発は、産官学の連携によって発展してきたが、同氏が開発したシステムは、上部・下部消化管における、胃がん、大腸ポリープの診断で、特異度、感度共に専門医と同等以上の精度を達成、全国の医療施設で使用されている。専門家と計算機によるリアルタイムダブルチェックが可能となっている。
以上のように、放射線画像以外にも、画像の蓄積が容易で、それによる専門医の診断結果の蓄積が容易な分野であれば、蓄積されたデータを用いて、深層学習によって画像診断用の診断エンジンを構築することが可能である。さらには、症例の蓄積が容易であれば、臨床試験デザインを組み、エビデンスの高い臨床試験が実現でき、それに基づく医療機器プログラムの構築は可能となってきている。
6. 生成AI
2021年のChatGPTの登場は、医療分野においても衝撃を与えた。当初、英語での7,000以上の出版物、インターネット上のリソースの学習によって、さまざまな分野についての専門的回答を可能にした。この学習過程は、リソースの増加によって、より大きな知識の利用が可能となっている。
研究として、この生成AIのエンジンを一から構築するという方法も試みられているが、現在診療現場において、生成AIの構築を単独で行うことが困難であることから、Retrieval-Augmented Generation:RAG(以下、RAG)を利用するシステムも開発され始めている。これは、大規模言語モデル(以下、LLM)が回答を生成する際に、外部のデータベースから関連情報を検索し、その情報を基に回答を生成する技術で、従来のLLMの学習データのみに依存する限界を克服し、より正確で最新の情報に基づいた、信頼性の高い回答を可能にしている。
ここでは、紙面の都合で、生成AIを使った2つのケースについて紹介する。
6.1 LLMによる文書生成支援[16]
2024年度、日本電気株式会社(以下、NEC)と東北大学病院が共同で取り組んだ「医師業務の効率化に向けた医療大規模言語モデルの研究開発と実用化」が、人工知能学会「現場イノベーション賞 金賞」として表彰された。
医療現場におけるAI活用としてLLMの導入は、精度の向上とリスクの軽減が課題であるが、カルテの構造化と文章生成のそれぞれに適した2つのLLMを用いる新方式を考案するとともに、構造化処理を担うLLMの学習データを低コストで増強する技術を開発し、医療用語の意味推論の精度改善を実現した。また、構造化処理によるカルテ整理を導入することで、医師による患者情報の把握とLLMの出力誤りの修正を容易にし、誤った情報が使われるリスクの軽減を実現した。当院の医師10名による評価で、医療文書の作成時間が半減することを実証した。2024年4月NECは本技術を搭載した国内初のLLM搭載カルテとして製品販売を始めている。
6.2 AIチャート[17]
もう一つの展開は、クリニック向けの電子カルテシステム「AIチャート」である。AIチャートは、クラウド型電子カルテシステムであるが、問診に対するWebインターフェイスの他、実際の診療時の医師の患者のやりとりを音声認識およびRAGを用いて、テキストに変換し、それをカルテ上に展開するというシステムを開発している。
7. おわりに
これまでの人工知能の医療応用について述べ、現在の動向についてまとめた。医師の仕事を「診断、治療およびそれらに関する文書作成」とすると、診断と文書作成については診療支援の目処がつきつつあるが、診断については大規模データの蓄積が可能な画像診断、文書作成には、医療に特化したLLMの構築によっており、それらが適用可能ではない部分には手が付けられない状況である。また、治療支援という部分では、ガイドラインによる治療の標準化が始まっているが、その治療過程を支援するところにまでは進んでいない。LLMが電子カルテを通しての治療支援に向かうのではないかという期待があるが、ここにもLLMが持っている技術的な課題を克服する必要があるだろう。また、現在537にものぼる診療ガイドラインによる診療支援を電子カルテシステムに実装する場合においても、LLMによる実装の方が容易かもしれない。
いずれにせよ、医療応用としてのAIはLLMを超えるような技術が登場しない限り、LLMと向き合わなければいけない時代に突入している。
参考文献
1. Mindsガイドラインライブラリ:https://minds.jcqhc.or.jp/
2. 日本神経学会「認知症疾患診療ガイドライン」:https://www.neurology-jp.org/guidelinem/nintisyo_2017.html
3. Shortliffe, E, 1976: Computer-Based Medical Consultations: MYCIN(PhD学位論文) https://www.shortliffe.net
4. Stuart Russell: Artificial Intelligence: A Modern Approach Webページから:https://aima.cs.berkeley.edu/figures.pdf
5. 人命救ったWatson「ゲノム解析」、米本社を説き伏せた日本人研究者の情熱 https://xtech.nikkei.com/atcl/nxt/column/18/01107/112200002/
6. 血液ガンに侵され、死を覚悟した女性を人工知能「Watson」が救った:https://www.itmedia.co.jp/enterprise/articles/1610/28/news062.html
7. 日経BP「インドのオンライン診療が熱い!」 https://project.nikkeibp.co.jp/behealth/atcl/feature/00004/092500075/
8. https://www.fda.gov/files/medical%20devices/published/US-FDA-Artificial-Intelligence-and-Machine-Learning-Discussion-Paper.pdf
9. Artificial Intelligence-Enabled Medical Devices:https://www.fda.gov/medical-devices/software-medical-device-samd/artificial-intelligence-enabled-medical-devices
10. PMDA:医療機器プログラム(SaMD)の審査ポイント https://www.pmda.go.jp/review-services/drug-reviews/about-reviews/devices/0047.html
11. 日本製薬工業協会 医薬品評価委員会 臨床評価部会部会資料:医療機器プログラム(SaMD)開発オーバービュー~開発プロセスと開発促進制度の整理~ https://www.jpma.or.jp/information/evaluation/results/allotment/tcjmdm0000001h5k-att/CL_202405_TF1_SaMD.pdf
12. https://www.pmda.go.jp/review-services/drug-reviews/review-information/devices/0018.html
13. Nodoca: https://nodoca.aillis.jp/
14. 内視鏡AI大全2025:https://gastro.igaku-shoin.co.jp/groups/ai_endoscopy
15. 日経メディカル:「内視鏡画像診断:支援AI、日本が世界でリードできる分野に」 https://medical.nikkeibp.co.jp/leaf/all/series/aileaders/202505/587443.html
16. https://www.hosp.tohoku.ac.jp/release/news/44776.html
17. AIチャート: https://gmo-healthtech.com/contents/aichart/feature/

 ヘルスケア
ヘルスケア 